Результаты отсроченного эндоваскулярного вмешательства у больных острым инфарктом миокарда с подъемом сегмента ST, обусловленным массивным тромбозом инфаркт-ответственной коронарной артерии
Азаров А. В., Семитко С. П., Глезер М. Г., Ахрамович Р. В., Малороев А. И.,
Мельниченко И. С., Атаров Г. Ю., Лебедев А. В.
ГБУЗ МО “Мытищинская городская клиническая больница”. Московская область; ФГБОУ ВО “Российский национальный исследовательский медицинский университет им. Н. И. Пирогова” Минздрава России. Москва;
ФГБОУ ВО “Первый Московский государственный медицинский университет им. И. М. Сеченова” Минздрава России. Москва.
Цель. Изучить клинические результаты и безопасность отсроченного vs экстренного стентирования с использованием современных антитромботических препаратов при массивном коронарном тромбозе у больных острым инфарктом миокарда с подъемом сегмента ST (ИМ↑ST).
Материал и методы. В исследование вошли 28 пациентов с острым ИМ↑ST в возрасте 52 (25-77) лет, из них мужского пола 80% (n=23), которые в период с января 2014г по февраль 2016г в первые 6-12 ч от начала развития заболевания получили эндоваскулярное лечение с целью восстановления адекватного кровотока без экстренной имплантации стента в инфаркт-ответственную артерию. Минимальная инвазивная стратегия с целью восстановления антеградного кровотока до уровня TIMI 2-3 была выполнена 14 (50%) больным. У всех больных после восстановления антеградного кровотока в просвете артерии визуализировался тромбоз по шкале TIMI thrombus grade score (TTG) ≥3. Следующим критерием эффективности являлась резолюция сегмента ST на ЭКГ ≥50%. В качестве антитромботической поддержки при вмешательстве все пациенты получали сочетание блокаторов IIb/IIIa гликопротеиновых рецепторов (эптифибатид) и 600 мг клопидогрела или 180 мг тикагрелора. Повторная коронароангиография (КАГ) выполнялась в сроки до 5 сут.
Результаты. На 4,0±1,0 сутки кровоток TIMI 2-3 в инфаркт-ответственной артерии был сохранен у 100% пациентов; отмечено значимое уменьшение степени целевого стеноза в инфаркт-связанной артерии с 77,8±10,2% до 50,5±19,5%; уменьшение его протяженности с 21,5±8,5 до 15,5±5,5 мм; увеличение референсного диаметра целевой артерии от 3,1±0,8 до 3,5±0,75 мм и степени тромбоза по шкале TTG — от 3,9 до 0,9. По результатам повторной КАГ стентирование целевого сегмента выполнено у 8 (29%) пациентов, а у 3 (10%) больных стентирование выполнено на основании данных внутрисосудистого ультразвукового исследования. У 17 (61%) пациентов инфаркт-ответственное стенотическое поражение признано незначимым. В группе отсроченного стентирования не было отмечено ни одного случая развития феноменов no/slow-reflow. На госпитальном этапе лечения в группе наблюдения кардиальных событий не зарегистрировано.
Заключение. У больных c массивным тромбозом инфаркт-зависимой артерии (TTG ≥3) и восстановленным антеградным коронарным кровотоком TIMI 2-3 отсроченное стентирование является безопасной и эффективной стратегией лечения на госпитальном этапе.
Ключевые слова: острый инфаркт миокарда с подъемом сегмента ST, чрескожное коронарное вмешательство, коронарное стентирование.
Кардиоваскулярная терапия и профилактика, 2017; 16(1): 40–45
http://dx.doi.org/10.15829/1728-8800-2017-1-40-45
Поступила 31/10-2016
Принята к публикации 11/11-2016
Чрескожное коронарное вмешательство (ЧКВ) является наиболее эффективным методом лечения больных инфарктом миокарда с подъемом сегмента ST (ИМ↑ST), поскольку снижает вероятность повторного инфаркта и улучшает прогноз в сравнении с тромболитической терапией [1]. Однако, несмотря на успешную реканализацию эпикардиальной части окклюзированной артерии, микроциркуляторная дисфункция, обусловленная дистальной эмболизацией, встречается у 5-10% всех больных и ассоциирована с худшим прогнозом. Попытки предотвратить микроциркуляторную дисфункцию использованием средств дистальной защиты оказались недостаточно эффективными [2]. Использование тромбоэкстракторов в подобной ситуации представляется перспективным, хотя в ряде случаев может приводить к увеличению зоны ИМ [3]. Задержка с имплантацией стента в течение нескольких сут. позволяет значимо уменьшить объем или полностью ликвидировать тромботический материал в инфаркт-ответственной артерии, и как следствие, снизить риск дистальной эмболизации и улучшить прогноз [4, 5]. Установлено, что ИМ↑ST в большинстве случаев обусловлен тромботической окклюзией магистральной артерии, и у ²/³ пациентов сопровождается наличием массивного тромбоза по данным ангиографической оценки индекс коронарного тромбоза —TTG ≥3) (TIMI thrombus grade score) (TTG 3) [5, 6].
Целью данного исследования было оценить эффективность и безопасность отсроченного стентирования у больных ИМ↑ST и массивным тромбозом инфаркт-ответственной артерии.
Материал и методы
Дизайн исследования: проспективное, несравнительное, одноцентровое исследование. В анализ включены данные 1194 пациентов, последовательно поступивших в блок реанимации и интенсивной терапии ГБУЗ МО “Мытищинская городская клиническая больница” в период с января 2014г по февраль 2016г с острым коронарным синдромом.
Критериями включения были:
• Острый (первичный) ИМ↑ST.
• Достижение коронарного кровотока по шкале TIMI (Thrombolysis in Myorardial Infarction) 2-3 [1, 7] в сочетании с резолюцией сегмента ST ≥50% в результате спонтанной реперфузии, либо медикаментозной (тромболитической) терапии, либо минимальной инвазивной стратегии при магистральной тромботической окклюзии.
• Индекс ангиографической оценки коронарного тромбоза (TIMI thrombus grade score) TTG ≥3 [7] (таблица 1).
ИМ диагностировали на основе общепринятых рекомендаций [8].Критериями не включения больных был тип С диссекции и выше, тромбоз ранее установленного стента, не связанного с индексным ИМ в бассейне инфаркт-связанной артерии, тромбоз незащищенного ствола левой коронарной артерии, поражение аутовенозных шунтов, невозможность проведения агрессивной двойной антиагрегантной терапии (ДАТ) по каким-либо причинам.
Фармакологическое сопровождение. На догоспитальном этапе, все больные получали ДАТ в виде ацетилсалициловой кислоты 300 мг/сут. в сочетании с клопидогрелом 600 мг/сут. или тикагрелором 180 мг. В качестве антикоагулянта использовался нефракционированный гепарин в дозе 5000 МЕ. В 6 случаях был проведен тромболизис метализой.
После проведения коронарной ангиографии (КАГ) все пациенты с целевым коронарным кровотоком TIMI 2-3 и наличием коронарного тромбоза TTG ≥3 в дальнейшем получали клопидогрел 150 мг/сут., либо тикагрелор 180 мг/сут. в сочетании с препаратами блокаторов IIb/IIIa гликопротеиновых рецепторов (эптифибатид) на срок от 24 до 48 ч (введение болюса и в/в инфузия в соответствии с инструкцией к препарату с учетом клиренса креатинина и массы тела больного). В качестве антикоагулянтной поддержки при вмешательстве пациенты получали нефракционированный гепарин до достижения активированного времени свертывания (activated clottingtime) 250-300 с (определения уровня гепаринизации).
С первых сут. заболевания больные получали β-адреноблокаторы, ингибиторы ангиотензин-превращающего фермента, статины, при необходимости — диуретики и ингибиторы протонной помпы. Дозы препаратов, влияющих на гемодинамику, титровали по артериальному давлению и частоте сердечных сокращений. После 48 ч и до 5 сут. клопидогрел назначали в стационаре в дозе 150 мг/сут., тикагрелор в дозе 180 мг/сут., далее по 75и 180 мг/сут., соответственно. Минимальная инвазивная стратегия. В группе пациентов c минимальной инвазивной стратегией целевой кровоток TIMI 2-3 достигался путем выполнения изолированной механической реканализации, механической реканализации сочетанной с применением баллонной ангиопластики при диаметре дилатационного баллонного катетера 1,5 или 2,0 мм, и тромбоаспирации, аспирационный катетер 6 Fr Export (Medtronic). КАГ проводили на ангиографическом комплексе Philips Allura FD 10 при поступлении и повторно на 2-5 сут. после. Оценивали ангиографическую степень коронарного тромбоза, степень и протяженность целевого стеноза, диаметр коронарной артерии.
Таблица 1
Шкала TTG (TIMI thrombus grade score) [10]
Ангиографическая оценка коронарного тромбоза по шкале ТТG
ТТG 0 нет ангиографических признаков тромбоза
ТТG 1 вероятно наличие тромба нарушение пристеночного контрастирования, неровность контуров сосуда
ТТG 2 тромб размером не более ½ инфаркт-ответственной артерии
ТТG 3 продольный размер тромба >½, но <2 диаметров инфаркт-ответственной артерии
ТТG 4 продольный размер тромба >2 диаметров инфаркт-ответственной артерии
ТТG 5 массивный тромбоз инфаркт-ответственной артерии
Таблица 2
Клиническая характеристика пациентов
Показатель Значение
Возраст, Me (Q1-Q3), годы 52 (25-77)
Мужской пол, % 80
Локализация ИМ
Нижний, % 90
Передний, % 10
Сахарный диабет, % 10
Артериальная гипертензия, % 38
Гиперлипидемия, % 43
(повышение ХС >5 ммоль/л
и/или ЛНП <3,5 ммоль/л)
Курение, % 70
Примечание: Ме — медиана (25-75 квартиль), ХС — холестерин,
ЛНП — липопротеины низкой плотности.
Имплантация стента в остаточный целевой стеноз инфаркт-связанной артерии после контрольной КАГ осуществлялась с учетом его значимости (>75%), подтвержденной в двух и более ортогональных проекциях; при стенозе <75% от имплантации стента решено было воздержаться с рекомендацией выполнения нагрузочных проб в восстановительном периоде заболевания. У нескольких больных проводили внутрисосудистое ультразвуковое исследование на аппарате I Lab (Boston Scientific): после катетеризации целевой коронарной артерии и системной гепаринизации (5000-10000 МЕ гепарина), ультразвуковой катетер Atlantis SR Pro проводили на 10 мм дистальнее поражения с последующим автоматическим моторизованным вытягиванием датчика со скоростью 1 мм/с до устья артерии. Оценивали морфологическую структуру атеросклеротической бляшки, ее площадь и объем, состояние сосуда и его ремоделирование.
Статистическая обработка результатов. При статистической обработке результатов использовали программу Statictica 8.0. Проверка нормальности распределения проводилась методом Колмагорова-Смирнова с поправкой Лиллиефорса. Количественный показатель представлялся в виде медианы (Ме) интерквартильный разброс (25-75%Q). Межгрупповые различия оценивались при помощи U-критерия Манна-Уитни. Сравнительный анализ независимых категориальных переменных использовался с применением χ2, либо точного теста Фишера. Во всех процедурах статистического анализа критический уровень значимости принимали p<0,05.
Результаты
Критериям включения и не включения в исследование соответствовало 28 пациентов, клиническая характеристика которых представлена в таблице 2. Анализируемая группа пациентов в основном была представлена мужчинами, с задней локализацией ИМ, у каждого десятого был сахарный диабет, >¹/³ пациентов имели в анамнезе артериальную гипертензию, почти ¾ больных курили. Коронарный анамнез у больных отягощен не был, ранее ангинозные боли не отмечали, настоящий ИМ был первым. Средняя продолжительность болевого синдрома до поступления составила 8±1,5 ч, время дверь — ангиография не превышало 15 мин. При диагностической КАГ у 25 (90%) больных инфаркт-ответственной артерией являлась правая коронарная артерия при правом типе коронарного кровоснабжения сердца и у 3 (10%) больных инфаркт-ответственной артерией являлась передняя межжелудочковая ветвь при правом типе коронарного кровоснабжения сердца. На момент поступления в рентгеноперационную из 28 пациентов у 14 (50%) больных отмечались признаки достижения целевой реперфузии в инфаркт-ответственной артерии, подтвержденные данными ЭКГ и субъективным регрессом клинической симптоматики. Кровоток TIMI 2-3 во время диагностической КАГ регистрировали у 14 больных: с признаками спонтанной целевой — у 11 (40%) больных и успешной тромболитической терапией у 3 (10%) больных.
Кровоток TIMI 0 отмечался у 12 (40%) больных, кровоток TIMI 1 — у 2 (10%) больных, соответственно. У 14 (50%) пациентов была применена минимальная инвазивная стратегия. По шкале TIMI trombus grade исходно тромбоз TTG 3 был диагностирован у 12 (40%) больных, TTG 4 — у 8 (30%) больных, TTG 5 (тотальный тромбоз инфаркт-связанной артерии) — также у 8 (30%) больных. Повторную КАГ проводили в сроки 2-5 сут. (в среднем 3,5 сут.). В промежутке между первичной и контрольной КАГ кардиальные события, обусловленные реокклюзией инфаркт-ответственной артерии, отсутствовали. Положительный ангиографический результат отмечен у 100% больных в виде: сохранение коронарного кровотока на уровне TIMI-3, уменьшение степени целевого стеноза с 77,8±10,2% до 50,5±19,5% (p<0,05); уменьшение его протяженности с 21,5±8,5 до 15,5±5,5 мм (p<0,01); увеличение референсного диаметра целевой артерии от 3,1±0,8 до 3,5±0,75 мм (p<0,01) и степени тромбоза по шкале TTG — от 3,9 до 0,9 (p<0,05). Имплантация стента была выполнена у 11 (39%) из 28 пациентов, у 17 (61%) больных процент остаточного стенозирования составлял не менее 50%±15%, однако в 3 случаях отмечались ангиографические признаки изъязвленной, нестабильной атеросклеротической бляшки в виде нечеткости и неровности ее краев и незначительного персистирования рентгенконтрастного вещества в зоне остаточного стенозирования. В связи с этим было выполнено внутрисосудистое ультразвуковое исследование, в ходе которого были выявлены осложненные стенозы с гистологической структурой преобладания некротического ядра и липидного компонента, с признаками положительного ремоделирования и сужением просвета по площади до 70%; на основании полученных данных было принято решение об имплантации стента. В ходе выполнения процедуры отсроченного стентирования случаев развития синдрома slow/no-reflow отмечено не было.
На рисунках 1 и 2 в качестве примеров приведены ангиограммы больных.
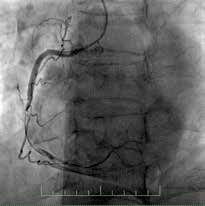
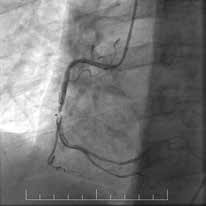
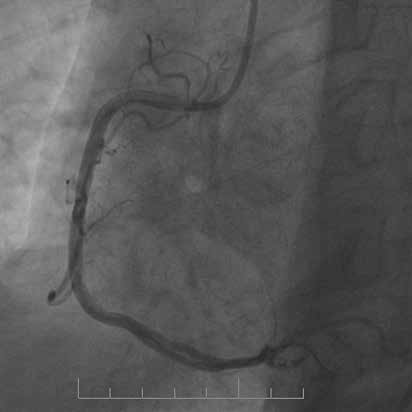
Рис. 1 Пациент с острым нижним ИМ↑ST:
A) Первичная КАГ — неокклюзирующий тромбоз TTG 4
с сохранением кровотока TIMI 3;
B) Повторная КАГ на 3 сут. — неокклюзирующий тромбоз
средней трети ПКА TTG 2 с сохранением кровотока TIMI 3;
С) Финальная КАГ с результатом отсроченного стентирова-
ния средней трети ПКА.
Примечание: ПКА — правая коронарная артерия.
Обсуждение
Реперфузионная терапия за последние десятилетия кардинально изменила лечение ИМ↑ST, большое количество рандомизированных исследований внесло огромный вклад в современную клиническую практику. В настоящем исследовании применили тактику отсроченного стентирования в сочетании с использованием современных внутривенных и пероральных антитромботических препаратов у пациентов с ИМ↑ST, обусловленным массивным коронарным тромбозом, при выполнении первичного ЧКВ, вопреки рутинной имплантации стента. По результатам контрольной КАГ у 61% больных было выявлено гемодинамически незначимое стенотическое поражение; необходимости в имплантации стента в инфаркт-ответственную артерию не было. Поскольку достижение целевого коронарного кровотока до уровня TIMI 2-3 является основной задачей первичного ЧКВ у пациентов с ИМ↑ST [1], обязательным условием для отсроченного стентирования было наличие адекватного антеградного коронарного кровотока у всех пациентов со спонтанной или медикаментозной тромболитической реперфузией и у пациентов в группе минимальной инвазивной стратегии.
Во избежание развития дистальной эмболизации и микроваскулярной обструкции в острой фазе ИМ имплантацию стента не выполняли. При контрольной КАГ кровоток TIMI 3 в инфаркт-ответственной артерии был сохранен у 100% пациентов. На госпитальном этапе лечения от момента выполнения первичной КАГ до контрольного исследования в группе наблюдения кардиальных событий обусловленных реоклюзией инфаркт-связанной артерии не было. В качестве фармакологической поддержки, помимо назначения стандартной ДАТ, при выполнении первичного инвазивного вмешательства применяли инфузию блокаторов IIb/IIIa гликопротеиновых рецепторов (эптифибатид). Назначение препаратов IIb/IIIa блокаторов гликопротеиновых рецепторов во время первичного ЧКВ улучшает кровоток в инфаркт-ответственной артерии и уменьшает летальность пациентов [8].
Принимая во внимание более высокую вероятность возникновения кровотечений из места пункции при сочетанном применении ДАТ и блокаторов IIb/IIIa гликопротеиновых рецепторов, которыемогут быть независимым предиктором госпитальной летальности [9] у всех наблюдавшихся больных вмешательство проводили трансрадиальным доступом, который обеспечивает более низкий уровень смертности, риска больших кровотечений и кровотечений из места доступа, несмотря на возможную большую длительность процедуры [10-12]. Ясно, что использование трансрадиального доступа требует достаточного опыта у оперирующего хирурга. В Сосудистом центре при ГБУЗ МО “Мытищинская городская клиническая больница” в год проводится ~1500 ангиографических исследований и 900 операций ЧКВ; в 90% случаев трансрадиальный доступ используется по умолчанию, как основной.
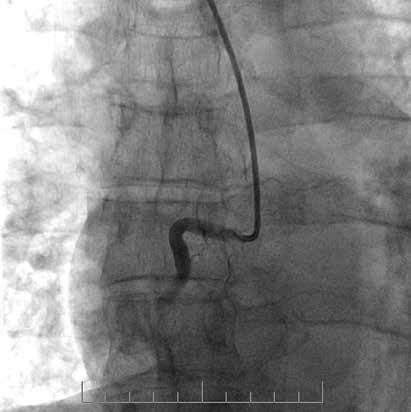
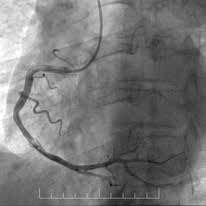
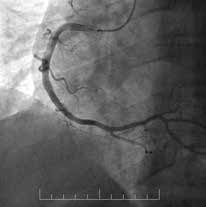
Рис. 2 Пациент с острым нижним ИМ↑ST:
A) Первичная КАГ — острая тромботическая окклюзия ПКА
с кровотоком TIMI 0;
В) Восстановление кровотока TIMI 3 — после проведения
первичной механической реканализации и тромбоэкстрак-
ции сохраняются признаки неокклюзивного тромбоза ТТG
3-4;
C) Контрольная КАГ на 5 сут. — полная резорбция тромбо-
тических масс.
Примечание: ПКА — правая коронарная артерия.
Двухэтапная методика отсроченного стентирования от 24 ч и до 5 сут. у пациентов с исходным коронарным кровотоком TIMI 3 с целью минимизации развития дистальной эмболизации и микровасулярной обструкции демонстрируют достаточно хорошие показатели [13]. В исследовании DEFER-STEMI (Randomised Controlled Study to Assess Whether Deferred Stenting in Acute STEMI Patients Might Reduce the Incidence of No-reflow Versus Conventional Treatment With Immediate Stenting — коротко Deferred Stent Trial in STEMI) отсроченное вмешательство (в среднем через 9 ч — 4-16 ч) позволило значимо уменьшить число пациентов с феноменом no/slow-reflow, получить более высокую градацию кровотока по TIMI [14]. Важно, что по данным магнитно-резонансного исследования индекс спасенного миокарда при отсроченном стентировании был существенно выше — 68% vs 56% (p=0,031) [15]. По данным мета-анализа, в основном нерандомизированных исследований, хотя и не было достоверных различий в частоте больших кровотечений, больших неблагоприятных событий при отсроченном и немедленном стентировании, но значимо меньшим было число внутригоспитальных ИМ — 39% vs 60%; относительный риск 0,55; 95% доверительный интервал (ДИ): 0,39-0,80) [16]. Однако отсроченное вмешательство без учета риска тромбоза при ИМ↑ST не показало преимуществ в отношении наступления комбинированной первичной точки, включавшей в себя все случаи смерти + госпитализации в связи с сердечной недостаточностью + повторные ИМ + любые незапланированные реваскуляризации крупных эпикардиальных артерий, в течение 2 лет наблюдения [17].
Результаты представленного исследования подтверждают хороший результат применения метода отсроченного стентирования у пациентов с ИМ↑ST с массивным коронарным тромбозом. Задержка имплантации стента у пациентов представляет собой альтернативную концепцию лечения данной категории пациентов. Этот подход может быть более сложным и дорогим, если сравнивать его с успешным результатом при рутинной одномоментной имплантации стента. Однако следует учитывать и тот факт, что микроваскулярная обструкция, в случае выполнения рутинного стентирования, у пациентов с ИМ↑ST может развиться и при наличии адекватного эпикардиального кровотока и без видимого тромбоза инфаркт-связанной артерии, таким образом, существует необходимость в более точных предикторах развития феномена “отсутствия кровотока” [6, 18]. Применение устройств дистальной протекции и тромбэкстракции, в ситуации с видимым массивным тромбозом инфаркт-связанной артерии, дает большие перспективы, однако нельзя не отметить противоречивые клинические результаты [3], в частности связанные с увеличением риска инсультов [18]. Ангиографические результаты, полученные в настоящей работе, демонстрируют, что задержка в имплантации стента в острой фазе ИМ, позволяет значимо уменьшить объем или полностью ликвидировать тромботический материал в инфаркт-ответственной артерии и, соответственно, снизить риск дистальной эмболизации. Описанный положительный ангиографический эффект в случаях имплантации стента в гемодинамически значимый остаточный стеноз, позволил более точно подобрать размеры стентов (больший диаметр, меньшая длина, использование более высокого давления баллона), что в дальнейшем окажет положительное влияние на снижение частоты тромбозов/рестенозов стентов. Однако можно полагать, что у пациентов, у которых по каким-либо причинам не удалось достичь целевого коронарного кровотока до уровня TIMI 2-3, использование такого метода может быть сопряженно с более высоким риском реокклюзии в инфаркт-ответственной артерии. Таким образом, полученные результаты относятся только к пациентам, у которых можно добиться кровотока TIMI 2-3 в инфаркт ответственной артерии без имплантации стента.
Заключение
У больных с ИМ↑ST, обусловленном массивным тромбозом инфаркт-ответственной артерии, задержка в имплантации стента в острой фазе может быть рассмотрена как возможный альтернативный метод лечения против экстренного стентирования, при условии стабильного восстановления кровотока в инфаркт-ответственной артерии до уровня TIMI 2-3 с использованием современных антитромботических препаратов в ходе первичного ЧКВ.
Литература
1. Levine GN, Bates ER, Blankenship JC, et al. 2015 ACC/AHA/SCAI Focused Update on
primary percutaneous coronary intervention for patients with ST-elevation myocardial
infarction: An Update of the 2011 ACCF/AHA/SCAI Guideline for percutaneous
coronary intervention and the 2013 ACCF/AHA Guideline for the management of
ST-elevation myocardial infarction. JACC 2016; 67(10): 1235-50.
2. Kelbaek H, Terkelsen CJ, Helqvist, et al. Randomized comparison of distal protection
versus conventional treatment in primary percutaneous coronary intervention. JACC
2008; 51: 899-905.
3. Vlaar PJ, Svilaas T, van der Horst IC, et al. Cardiac death and reinfarction after 1 –
year in the Trombus Aspiration during Percutaneous coronary intervention in Acute
myocardial infarction Study (TAPAS): a 1-year follow-up study. Lancet 2008; 371:
1915-20.
4. Henning K, Engstrom T, Ahtarovski K, et al. Deferred stent implantation in patients
with ST-segment elevation myocardial infarction: a pilot study. EuroIntervention 2013;
8(10): 1126-33.
5. Vecchio S, Varani E, Chechi T, et al. Coronary thrombus in patients undergoing
primary PCI for STEMI: Prognostic significance and management. World J Cardiol
2014; 6(6): 381-92.
6. Sianos G, Papafaklis MI, Daemen J, et al. Angiographic stent thrombosis after
routine use of drug-eluting stents in ST-segment elevation myocardial infarction: the
importance of thrombus burden. JACC 2007; 50: 573-83.
7. Gibson CM, de Lemos JA, Murphy SA, et al. Combination therapy with abciximab
reduces angiographically evident thrombus in acute myocardial infarction: a TIMI 14
substudy. Circulation 2001; 103: 2550-4.
8. Montalescot G, Borentain M, Payot L, et al. Early vs late administration of glycoprotein
IIb/IIIa inhibitors in primary percutaneous coronary intervention of acute ST-segment
elevation myocardial infarction: a meta-analysis. JAMA 2004; 292(3): 362-6.
9. Vranckx P, Campo G, Anselmi M, et al. Does the site of bleeding matter? A stratified
analysis on location of TIMI-graded bleedings and their impact on 12-month outcome
in patients with ST-segment elevation myocardial infarction. EuroIntervention 2012;
8(1): 71-8.
10. Karrowni W, Vyas A, Giacomino B, et al. Radial versus femoral access for primary
percutaneous interventions in ST-segment elevation myocardial infarction patients:
a meta-analysis of randomized controlled trials. JACC Cardiovasc Interv 2013; 6(8):
814-23.
11. Joyal D, Bertrand OF, Rinfret S, et al. Meta-analysis of ten trials on the effectiveness
of the radial versus the femoral approach in primary percutaneous coronary
intervention. Am J Cardiol 2012; 109: 813-8.
12. Baklanov DV, Kaltenbach LA, Marso SP, et al. The prevalence and outcomes of
transradial percutaneous coronary intervention for ST segment elevation myocardial
infarction: analysis from the National Cardiovascular Data Registry (2007 to 2011).
JACC 2013; 61: 420-6.
13. Tang L, Zhou SH, Hu XQ, et al. Effect of delayed vs immediate stent implantation
in myocardial perfusion and cardiac function in patients with ST-elevation acute
myocardial infarction undergoing primary PCI with thrombus aspiration. Can J
Cardiol. 2011; 27(5): 541-7.
14. Carrick D, Oldroyd KG, McEntegart M, et al. A randomized trial of deferred stenting
versus immediate stenting to prevent no- or slow-reflow in acute ST-segment
elevation myocardial infarction (DEFER-STEMI). JACC 2014; 63(20): 2088-98.
15. Freixa X, Belle L, Joseph L, et al. Immediate vs. delayed stenting in acute myocardial
infarction: a systematic review and meta-analysis. EuroIntervention 2013; 8(10):
1207-16.
16. Kelbæk H, Høfsten DE, Køber L, et al. Deferred versus conventional stent implantation
in patients with ST-segment elevation myocardial infarction (DANAMI 3-DEFER): an
open-label, randomised controlled trial. Lancet 2016; 387(10034): 2199-206.
17. Brodie BR, Stuckey TD, Hansen C, et al. Relation between ECG ST-segment
resolution myocardial infarction: analysis from the National Cardiovascular Data
Registry (2007 to 2011). JACC 2013; 61: 420-6.
18. Jolly SS, Cairns JA, Yusuf S, et al. TOTAL Investigators. Outcomes after thrombus
aspiration for ST elevation myocardial infarction: 1-year follow-up of the prospective
randomised TOTAL trial. Lancet 2016; 387(10014): 127-35.






