Режим работы Единого контакт-центра:
ежедневно с 8:00 до 20:00
тел: +7 (499) 450-88-89
ежедневно с 8:00 до 20:00
тел: +7 (499) 450-88-89
Служба контроля качества
+7(499) 450-49-89
+7(499) 450-49-89
Флуоресцентная диагностика и фотодинамическая терапия в комбинированном лечении холангиоцеллюлярного рака
А.А. Ширяев, Г.Х. Мусаев, М.В. Лощенов, А.В. Бородкин, В.В. Левкин, Н.Л. Охотникова, В.В. Волков, В.И.Макаров, В.Б. Лощенов
Флуоресцентная диагностика и фотодинамическая терапия в комбинированном лечении холангиоцеллюлярного рака
Резюме
В статье представлены результаты пилотного исследования по применению комбинированного лечения нерезектабельной холангиокарциномы, осложненной механической желтухой. Метод включал в себя чрескожное чреспеченочное желчеотведение, эндовидеофлуоресцентную диагностику, фотодинамическую терапию опухолевой стрикутры и стентирование желчных протоков. В исследование были включены 14 пациентов, находящихся на лечении в клинике факультетской хирургии имени Н.Н. Бурденко Первого Московского государственного медицинского университета им. И.М. Сеченова. Флуоресцентную диагностику и фотодинамическую терапию проводили с применением фотосенсибилизаторов фотосенс (0,5 мг/кг), фотолон (1,0 мг/кг) и радахлорин (1,0 мг/кг). Средняя доза лазерного облучения за один сеанс составила 115±5 Дж/см2. Флуоресцентная диагностика с использованием эндовидеофлуоресцентного модуля для эндоскопии и минимальноинвазивной хирургии позволила получить видеофлуоресцентное изображение опухоли и оценить уровень флуоресценции фотосенсибилизатора в опухоли у всех пациентов. Морфологически злокачественный процесс подтвержден у 12 пациентов, у 2 пациентов с опухолью Клатскина не удалось забрать материал из желчных протоков для морфологического исследования. Первоначальные результаты применения комбинированного минимальноинвазивного лечения оценены, как обнадеживающие. У 4 пациентов продолжительность жизни после лечения составила 21, 17, 13 и 11 мес. 5 пациентов находятся в настоящее время под динамическим наблюдением. Из них 2 наблюдаются со сроком 13 и 19 мес, и 3 – от 4 до 6 мес. 5 больных, которые изначально имели множественные отдаленные метастазы, умерли в течение 3±1 мес после проведенного лечения. Средняя продолжительность жизни у пролеченной группы пациентов составляет на данный момент 9,5 мес, но следует ожидать ее повышения вследствие того, что 5 из 14 больных в настоящий момент живы. Ключевые слова: нерезектабельная холангиокарцинома, чрескожное желчеотведение, видеофлуоресцентная диагностика, фотодинамическая терапия, стентирование опухолевой стриктуры.
Для цитирования: Ширяев А.А., Мусаев Г.Х., Лощенов М.В., Бородкин А.В., Левкин В.В., Охотникова Н.Л., Волков В.В., Макаров В.И., Лощенов В.Б. Флуоресцентная диагностика и фотодинамическая терапия в комбинированном лечении холангиоцеллюлярного рака. – 2016. – Т. 5, № 4. – С. 15–24.
Введение
Холангиоцеллюлярный рак (ХЦР) – заболевание, характеризующееся медленным ростом, поздним метастазированием и имеющее плохой прогноз [1, 2]. Известно, что радикальная операция возможна примерно у 20% больных с этим диагнозом. Причиной этому является частая инвазия опухоли в сосуды ворот печени и ее паренхиму, наличие гнойного холангита, билиарного цирроза и других осложнений основного процесса [3]. Кроме того, чаще всего указанная патология определяется у пациентов пожилого возраста с множественными сопутствующими заболеваниями [4, 5]. При успешном хирургическом лечении 5-летняя выживаемость составляет от 20% до 40% [4]. В случае нерезектабельной опухоли продолжительность жизни не превышает 4–6 мес. Эти сроки уменьшаются при развитии желтухи [4, 5]. Основной причиной является фатальная печеночная недостаточность, которая развивается вследствие распространения опухолевого процесса по желчным протокам, приводящего к их непроходимости, а также быстрое присоединение на этом фоне холангита. К сожалению, следует отметить, что большинство больных с холангиоцеллюлярным раком умирает в течение первого года после установления диагноза [6, 7]. Механическая желтуха значительно усугубляет течение заболевания, хотя и является чаще всего манифестным симптомом, из-за которого пациент попадает в стационар [1, 8, 9]. Несмотря на совершенствование методов диагностики, решение проблемы механической желтухи и причины ее появления нередко сопряжены с определенными трудностями. Обусловлены они тем, что этому контингенту больных наравне со срочными диагностическими манипуляциями и интенсивной терапией требуется срочный и правильный выбор метода лечения, что во многом зависит от причины билиарного блока и его протяженности. Инструментальная и лабораторная диагностика непосредственно механической желтухи, в частности желчной гипертензии, не составляет особого труда. В то же время диагно
стика ХЦР, а тем более его морфологическая верификация может представлять определенные сложности. Нередко диагноз удается подтвердить только во время радикальной операции при морфологическом исследовании удаленной опухоли [10, 11, 12]. С целью диагностики ХЦР применяют целый ряд неинвазивных и инвазивных методов. Первая группа методов – это ультразвуковое исследование, компьютерная или магниторезонансная томография. Ко второй группе относятся эндоскопическая ретроградная холангиопанкреатография и чрескожная чреспеченочная холангиография [1, 3]. Они позволяют не только точно установить локализацию, протяженность стриктуры и характер блока контрастирования (полный или частичный), но и выполнить дренирование желчных протоков, а также осуществить забор материала для морфологического исследования. Разрабатываются и другие методы диагностики, в частности метод флуоресцентной гибридизации in situ (FISH) для определения рака желчных протоков как в биопсийном материале, так и в аспиратах желчи. Ряд авторов считают, что данная методика более чувствительна для подтверждения злокачественного характера билиарных стриктур в отличие от традиционных способов диагностики [13]. Первоочередной задачей при развитии механической желтухи является снижение желчной гипертензии, которая достигается выполнением процедуры желчеотведения [6, 7, 8, 10, 14, 15]. Для этого применяют различные способы антеградного или ретроградного дренирования желчных протоков. Выбор способа зависит от локализации опухоли, а также от технических возможностей лечебного учреждения и квалификации его сотрудников [5, 16, 17]. К самым распространённым способам минимальноинвазивого чрескожного желчеотведения под контролем УЗИ и рентгеноскопии относят наружную, наружно-внутреннюю холангиостомию и стентирование желчных протоков [7, 10, 14]. Чрескожная наружная холангиостомия заключается в отводе желчи из желчного дерева наружу. При этом дистальная часть дренажа фиксируется в желчных протоках над стриктурой или в просвете желчного пузыря (холецистостома). При этой методике возможна быстрая и адекватная санация желчных протоков, поэтому чаще всего ее используют в качестве первого этапа лечения при планировании радикальной операции или стентировании желчных протоков, а также у больных с терминальной стадией заболевания, как окончательный вариант лечения [7, 14]. При чрескожной наружно-внутренней холангиостомии конечная часть дренажа располагается ниже стриктуры, чаще в просвете кишечника, а множественные перфорирующие дренаж отверстия – выше и ниже области стриктуры желчного протока [14]. При этом виде дренирования желчь поступает в просвет кишечника, но имеется вероятность развития холангита. Стентирование желчных протоков, помимо того, что позволяет наладить отток желчи, улучшает качество жизни пациента ввиду отсутствия внешней части дренажа на брюшной стенке. Основным ограничением стентирования является высокая стоимость расходных материалов относительно других способов билиарного дренирования [6, 10, 14]. Следует отметить, что выбор варианта дренирования желчных путей, как окончательного метода лечения, также зависит от предполагаемой продолжительности жизни больного. Если ожидаемая продолжительность жизни составляет более 3 мес, то предпочтение следует отдавать стентированию желчных протоков [8, 18]. Минимальноинвазивные методики дренирования желчных протоков в той или иной степени отработаны и широко применяются в клинической практике. При диагностике причины билиарной гипертензии локализацию и протяженность стриктуры желчных протоков возможно выявить на стадии выполнения желчеотведения. Трудности возникают при морфологической верификации диагноза ХЦР, поскольку существуют сложности со взятием материала для гистологического исследования. В большинстве стационаров желчеотведение является окончательным методом паллиативного лечения и после купирования явлений желтухи больных выписывают с дренажем под наблюдение врачей по месту жительства без какого-либо противоопухолевого лечения. В случае стентирования стриктуры большой проблемой также является прорастание опухолью непокрытого стента или распространение опухолевой инфильтрации за его границы. Это приводит к повторной механической желтухе [8, 11, 13, 19]. Целью нашей работы было усовершенствование методов диагностики и лечения нерезектабельного рака желчных протоков с использованием методов флуоресцентной диагностики (ФД) и фотодинамической терапии (ФДТ).
стика ХЦР, а тем более его морфологическая верификация может представлять определенные сложности. Нередко диагноз удается подтвердить только во время радикальной операции при морфологическом исследовании удаленной опухоли [10, 11, 12]. С целью диагностики ХЦР применяют целый ряд неинвазивных и инвазивных методов. Первая группа методов – это ультразвуковое исследование, компьютерная или магниторезонансная томография. Ко второй группе относятся эндоскопическая ретроградная холангиопанкреатография и чрескожная чреспеченочная холангиография [1, 3]. Они позволяют не только точно установить локализацию, протяженность стриктуры и характер блока контрастирования (полный или частичный), но и выполнить дренирование желчных протоков, а также осуществить забор материала для морфологического исследования. Разрабатываются и другие методы диагностики, в частности метод флуоресцентной гибридизации in situ (FISH) для определения рака желчных протоков как в биопсийном материале, так и в аспиратах желчи. Ряд авторов считают, что данная методика более чувствительна для подтверждения злокачественного характера билиарных стриктур в отличие от традиционных способов диагностики [13]. Первоочередной задачей при развитии механической желтухи является снижение желчной гипертензии, которая достигается выполнением процедуры желчеотведения [6, 7, 8, 10, 14, 15]. Для этого применяют различные способы антеградного или ретроградного дренирования желчных протоков. Выбор способа зависит от локализации опухоли, а также от технических возможностей лечебного учреждения и квалификации его сотрудников [5, 16, 17]. К самым распространённым способам минимальноинвазивого чрескожного желчеотведения под контролем УЗИ и рентгеноскопии относят наружную, наружно-внутреннюю холангиостомию и стентирование желчных протоков [7, 10, 14]. Чрескожная наружная холангиостомия заключается в отводе желчи из желчного дерева наружу. При этом дистальная часть дренажа фиксируется в желчных протоках над стриктурой или в просвете желчного пузыря (холецистостома). При этой методике возможна быстрая и адекватная санация желчных протоков, поэтому чаще всего ее используют в качестве первого этапа лечения при планировании радикальной операции или стентировании желчных протоков, а также у больных с терминальной стадией заболевания, как окончательный вариант лечения [7, 14]. При чрескожной наружно-внутренней холангиостомии конечная часть дренажа располагается ниже стриктуры, чаще в просвете кишечника, а множественные перфорирующие дренаж отверстия – выше и ниже области стриктуры желчного протока [14]. При этом виде дренирования желчь поступает в просвет кишечника, но имеется вероятность развития холангита. Стентирование желчных протоков, помимо того, что позволяет наладить отток желчи, улучшает качество жизни пациента ввиду отсутствия внешней части дренажа на брюшной стенке. Основным ограничением стентирования является высокая стоимость расходных материалов относительно других способов билиарного дренирования [6, 10, 14]. Следует отметить, что выбор варианта дренирования желчных путей, как окончательного метода лечения, также зависит от предполагаемой продолжительности жизни больного. Если ожидаемая продолжительность жизни составляет более 3 мес, то предпочтение следует отдавать стентированию желчных протоков [8, 18]. Минимальноинвазивные методики дренирования желчных протоков в той или иной степени отработаны и широко применяются в клинической практике. При диагностике причины билиарной гипертензии локализацию и протяженность стриктуры желчных протоков возможно выявить на стадии выполнения желчеотведения. Трудности возникают при морфологической верификации диагноза ХЦР, поскольку существуют сложности со взятием материала для гистологического исследования. В большинстве стационаров желчеотведение является окончательным методом паллиативного лечения и после купирования явлений желтухи больных выписывают с дренажем под наблюдение врачей по месту жительства без какого-либо противоопухолевого лечения. В случае стентирования стриктуры большой проблемой также является прорастание опухолью непокрытого стента или распространение опухолевой инфильтрации за его границы. Это приводит к повторной механической желтухе [8, 11, 13, 19]. Целью нашей работы было усовершенствование методов диагностики и лечения нерезектабельного рака желчных протоков с использованием методов флуоресцентной диагностики (ФД) и фотодинамической терапии (ФДТ).
Материал и методы
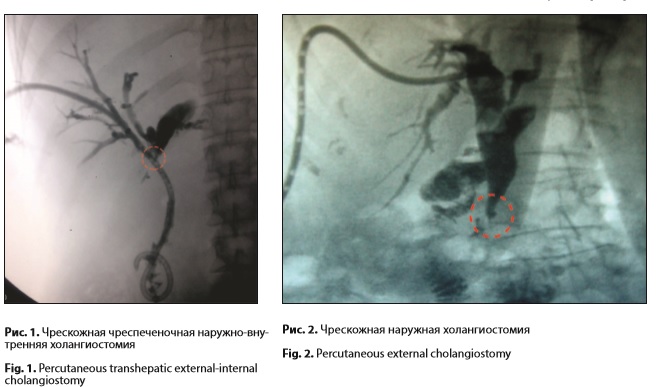
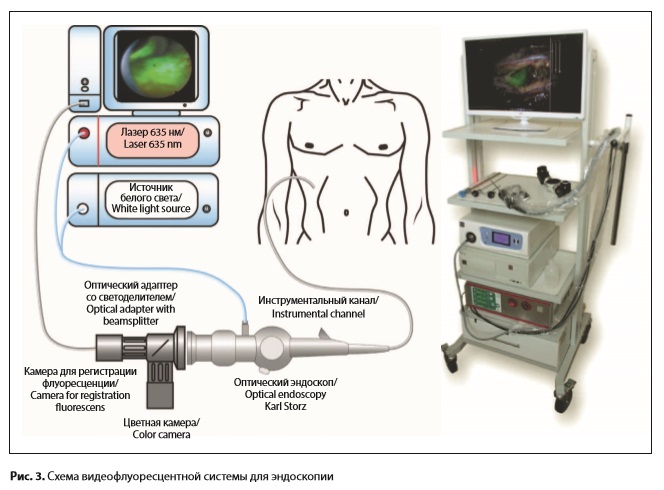
В исследование было включено 14 пациентов с подозрением на ХЦР, находящихся на лечении в Клинике факультетской хирургии имени Н.Н. Бурденко Первого Московского государственного медицинского университета им. И.М. Сеченова, которым было выполнено комбинированное минимальноинвазивное лечение. Средний возраст больных составил 67±12 лет. Мужчин было 8, женщин – 6. У 7 пациентов было выявлено поражение общего печеночного протока, у 5 – нодулярная карцинома с поражением общего печеночного протока с переходом на бифуркацию долевых протоков, у 2 – опухоль проксимального отдела общего желчного протока (у 1 из них с переходом на пузырный проток). У 7 пациентов были диагностированы отдаленные метастазы (регионарные лимфоузлы, печень, легкие). Радикальная операция не могла быть выполнена по причине распространенности процесса (множественные метастазы) или функционального состояния больного (возраст, сопутствующая патология). Оценка функционального состояния больных производилась по шкале Карновского. Получены следующие результаты: у 5 пациентов – 20% активности, у 4 – 30% активности, у 2 – 50% активности, и у 3 – 70% активности. Всем пациентам было выполнено комбинированное минимальноинвазивное лечение, которое состояло из следующих этапов: 1. Чрескожное чреспеченочное желчеотведение под ультразвуковым и рентгеноскопическим контролем. 2. Чресфистульная эндовидеофлуоресцентная диагностика с прицельной биопсией. 3. Фотодинамическая терапия опухоли. 4. Стентирование желчных протоков. Первым этапом, для уменьшения желчной гипертензии, выполняли чрескожное чреспеченочное желчеотведение под контролем УЗИ и рентгеноскопии. 12 пациентам было выполнено наружно-внутреннее желчеотведение (рис. 1). У 2 пациентов с опухоль Клатскина удалось осуществить только наружное желчеотведение (рис. 2), которое в последующем было переведено в наружно-внутреннее. После стабилизации состояния на 2–3 сутки выполняли эндовидеофлуоресцентную и локальную флуоресцентную спектроскопию (ЛЭСА-6, ЗАО «БИОСПЕК», длина волны 633 нм). Флуоресцентную диагностику проводили через установленный в желчные протоки интрадьюсер диаметром 9 Fr (3 мм), при помощи видеофлуоресцентного модуля для эндоскопии и минимальноинвазивной хирургии, разработанного в ЗАО «БИОСПЕК», и гибкого тонкого оптического эндоскопа производства Karl Storz диаметром 2,8 мм (рис. 3, 4).
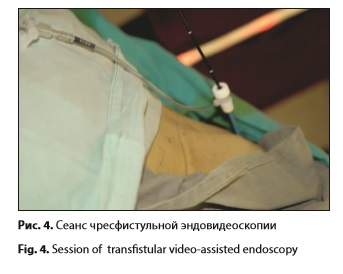
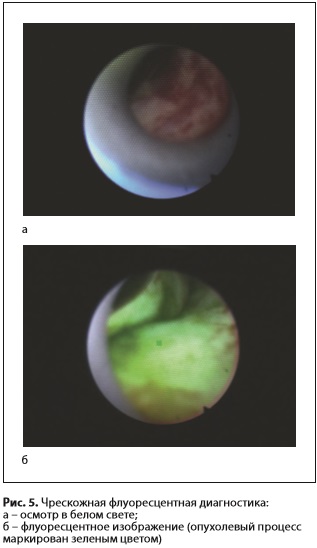
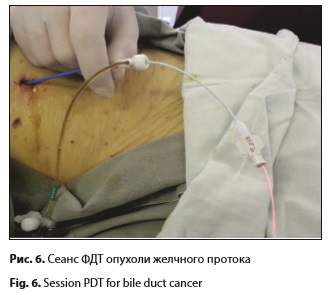
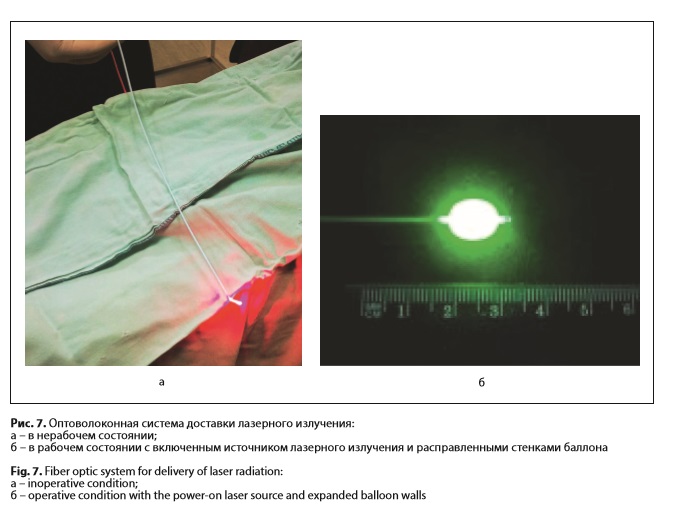
При помощи модуля получали видеофлуоресцентное изображение опухоли. На экране монитора присутствует интерактивная метка-мишень, которую можно наводить на различные участки видеофлуоресцентного изображения, определяя уровень накопления фотосенсибилизатора в тканях. Биопсию из подозрительных на наличие опухолевого процесса тканей проводили эндоскопическими щипцами через биопсийный канал эндоскопа. В качестве фотосенсибилизатора использовали один из следующих препаратов: • фотосенс (ФГУП «ГНЦ «НИОПИК», Россия, регистрационное удостоверение РN000199/02 от 04.03.2010) в дозе 0,5 мг/кг внутривенно за 24 ч до процедуры; • радахлорин (ООО «РАДА-ФАРМА», Россия, регистрационное удостоверение №ЛС-001868 от 16.12.2011) в дозе 1,0 мг/кг внутривенно за 3–5 ч до процедуры; • фотолон (РУП «Белмедпрепараты», Республика Беларусь) в дозе 1,0 мг/кг внутривенно за 3–5 ч до процедуры. При помощи видеофлуоресцентного модуля проводили диагностику, позволившую получить видеофлуоресцентную картину опухоли желчных протоков (рис. 5). Средняя мощность лазерного излучения во время ФД составила 2 мВт, плотность энергии лазерного излучения не превышала 1 Дж/см2. После эндовидеофлуоресцентной диагностики проводили сеанс ФДТ (рис. 6). Для проведения сеанса ФДТ в просвет желчных протоков вводили оптоволоконную систему ЛФТ675-01-БИОСПЕК (ЗАО «БИОСПЕК», Россия) с длиной волны излучения 670 нм. Мощность на выходе лазерной системы излучения составила 1,5 Вт, что позволило получить, с учетом потерь на волокнев размере 20±5%, плотность мощности излучения 160±5 мВт/см2. Продолжительность сеансов составила 12±2 мин, средняя плотность энергии –115±10Дж/см2. Для облучения использовали гибкий оптоволоконный световод с цилиндрическим облучателем на дистальном конце. Облучатель выводили из дренажного канала и осуществляли облучение. Впоследствии совместно с ЗАО «БИОСПЕК» был разработан баллонный катетер, дистальная часть которого расширялась в просвете протока разведенным в 20 раз раствором липофундина для более равномерного воздействия на опухоль. Световод с цилиндрическим облучателем при этом располагался на уровне раздутого баллона (рис. 7 а, б). Эндопротезирование желчных протоков, как завершающий этап лечения больных нерезектабельным ХЦР, выполняли сразу же после сеанса ФДТ. Стент устанавливали непосредственно в область стриктуры, края его фиксировали, отступая на 1–2 см от края опухоли. Размеры стентов подбирали индивидуально, в зависимости от локализации и протяженности стриктуры. У 9 пациентов применяли покрытые саморасширяющиеся нитиноловые стенты длиной от 4 до 10 см и диаметром 8–10 мм. При распространении опухоли на конфлюенс долевых протоков и/или один из долевых протоков стентирование осуществляли непокрытым стентом длиной 4–6 см, диаметром 8 мм (у 5 пациентов). Делали это по причине того, что желчное древо состоит не из изолированных сегментов, так что только непокрытый нитиноловый стент позволяет достигнуть адекватного оттока желчи, особенно при поражении области бифуркации долевых протоков. Хотя известно, что непокрытый стент может быстрее прорастать опухолью, чем покрытый, вследствие чего возникает механическая желтуха, что требует повторного желчеотведения [11, 20].
Результаты и обсуждение Комбинированное минимальноинвазивное лечение, включающее желчеотведение, ФД, ФДТ и стентирование проведено 14 пациентам. Верифицировать морфологически диагноз холангиоцеллюлярного рака удалось у 12 пациентов из 14. У 2 больных с опухолью Клатскина технически не удалось взять материал. С трудностями биопсии опухоли данной локализации сталкивались и другие авторы [11, 13]. 12 пациентов хорошо перенесли процедуру, осложнений не было. У 2 пациентов в первые сутки отмечен холангит, который был купирован за счет декомпрессии желчных протоков и инфузионной терапии. Фототоксических реакций не отмечено, все больные соблюдали световой режим. Первоначальные результаты, полученные у пролеченных пациентов, можно оценить как обнадеживающие. Наибольшая продолжительность жизни (21 мес) отмечена у одного пациента, трое прожили 17, 13 и 11 мес, соответственно. Пять пациентов находятся в настоящее время под динамическим наблюдением. Из них двое наблюдаются со сроком 13 и 19 мес, а трое – от 4 до 6 мес. Пятеро больных, которые изначально имели множественные отдаленные метастазы, умерли в течение 3±1 мес после проведенного лечения. Средняя продолжительность жизни у пролеченной группы пациентов составляет на данный момент 9,5 мес, но следует ожидать ее повышения вследствие того, что 5 из 14 больных живы. У 12 из 14 пациентов удалось сразу провести наружно-внутреннее желчеотведение и после ФД и ФДТ выполнить стентирование стриктуры. У 2 пациентов при желчеотведении во время фистулографии выявлен полный блок контрастирования общего печеночного протока. Многочисленные попытки провести проводник и/или получить контрастирование протока дистальнее стриктуры были безуспешны. В связи с чем этим пациентам была установлена наружная холангиостома и после стабилизации состояния были выполнены ФД и ФДТ. На третий день после ФДТ и декомпрессии желчных протоков при фистулографии у этих пациентов была отмечена частичная реканализация протока. Контрастный препарат свободно поступал в просвет кишечника. Этим пациентам был повторно проведен сеанс ФДТ с целью облучения опухолевой стриктуры на всем протяжении и установлен стент. Следует отметить, что желчеотведение и многокомпонентную дезинтоксикационную терапию (инфузионную терапию, стимуляцию диуреза, борьбу с другими видами полиорганной недостаточности и т.д.) следует проводить в максимально ранние сроки с момента госпитализации больного. Тем не менее, механическая желтуха не является противопоказанием для ФД и ФДТ, в отличие от химиотерапии [21]. Фотосенсибилизаторы фотосенс, радахлорин и фотолон применяли как для диагностики, так и для лечения. В настоящем исследовании у 3 пациентов использовали фотосенс, у 7 – радахлорин и у 4 – фотолон.
Все эти препараты можно использовать не только для однократной, но и для многокурсовой ФДТ [22]. Преимущество препаратов хлоринового ряда (радахлорин и фотолон) обусловлено более быстрым периодом выведения их из организма – до 48 ч, и небольшим сроком соблюдения светового режима пациентами. Однако для повторного проведения ФДТ необходимо дополнительное введение препарата. Что касается препарата фотосенс, то он имеет особенность длительно удерживаться в тканях (до 30% от максимальных значений определяется в течение недели после внутривенного введения), что дает возможность проведения до 5-7 сеансов облучения в эти сроки с коррекцией дозы лазерного облучения [22]. В дальнейшем концентрация препарата медленно снижается. В следовых количествах (0,1 мкг/мл и менее) он обнаруживается до 14 нед после введения. Длительный период выведения препарата обуславливает его фототоксичность и требует длительного соблюдения светового режима. Методика диагностики опухоли желчных протоков, выполняемая с использованием видеофлуоресцентного модуля для эндоскопии и минимальноинвазивной хирургии, основана на преимущественном накоплении фотосенсибилизаторов в злокачественных новообразованиях по сравнению со здоровыми тканями. При этом представляется возможность визуально за счет флуоресценции определить границы опухолевого поражения [23–27]. Идентичные исследования были проведены в различных учреждениях, о чем свидетельствуют публикации в периодической печати [19, 23, 26, 28]. У всех 14 пациентов было получено видеофлуоресцентное изображение опухоли желчных протоков. При этом показано, что одновременно возможно произвести измерение уровня накопления фотосенсибилизатора в интересующих участках по уровню его флуоресценции. В нашем исследовании была использована новая диагностическая установка, которая позволяет одновременно получать визуальное изображение флуоресценции и диагностический параметр, характеризующий уровень накопления фотосенсибилизатора в тканях. Уровень накопления фотосенсибилизатора в опухоли превышал в два раза и более уровень его накопления в нормальной ткани. Следует отметить, что для удобства диагностики эндоскоп следует проводить через двухканальный интрадьюсер, позволяющий одновременно с исследованием промывать желчные протоки от поступающей в поле зрения желчи и крови, которые могут давать ложную флуоресценцию или, наоборот, экранировать лазерное излучение. У 1 из 14 пациентов был установлен непокрытый нитиноловый стент в область стриктуры общего желчного протока и проведена ФДТ. Через 9 мес после операции у пациента были отмечены признаки желчной гипертензии, которые были связаны с распространением опухолевой инфильтрации выше стента с образованием стриктуры общего печеночного протока. После того как было выполнено желчеотведение, при фистулографии было установлено, что просвет стента проходим для контрастного препарата. Пациенту был выполнен повторный курс ФДТ с последующим рестентированием по типу стент в стент (рис. 8). После лечения пациент прожил еще 12 мес, сохраняя трудовую и социальную активность. Что касается основной причины повторной желтухи после ранее выполненного стентирования, то мы считаем, что это обусловлено обструкцией стента за счет врастания опухоли в непокрытый стент и распространением опухолевой инфильтрации за его границы. Такого же мнения придерживаются другие авторы [12, 13, 29, 30]. Поэтому крайне важно наладить как можно более длительную проходимость протоков для улучшения качества жизни пациентов [11]. Для предотвращения прогрессирования заболевания могут применяться различные методики локорегионарного воздействия, в частности внутрипротоковая лучевая, химиотерапия и фотодинамическая терапия [11, 19, 28, 29]. При этом в случае лучевой терапии необходимость подведения больших доз излучения несет в себе потенциальные риски развития осложнений и повреждений окружающих тканей и органов, как во время лечения, так и в отдаленном периоде [2]. Что касается химиотерапии, то в качестве самостоятельного метода лечения ХЦР она малоэффективна, частичный эффект не превышает 20–30% [2, 24]. Кроме того, желтуха, печеночная недостаточность и сопутствующий холангит затрудняют ее применение у такой категории больных. Мы в своей работе основывались на локорегионарном фотодинамическом воздействии на опухолевую стриктуру желчных протоков [22, 25, 26]. При этом возникает фотохимическая реакция, вызывающая образование синглетного кислорода, который воздействует на опухолевые клетки, вызывая их гибель [9]. Кроме того, помимо прямого фототоксического воздействия на опухолевые клетки, важную роль в механизме деструкции имеет нарушение кровоснабжения опухоли за счет микротромбоза и повреждения эндотелия питающих опухоль сосудов [22]. На сосудистый механизм приходится до 60% противоопухолевого действия ФДТ. Наряду с этим, ФДТ стимулирует иммунные реакции организма против опухоли как за счет активации лимфоцитов, нейтрофилов и макрофагов в подвергнутой ФДТ ткани опухоли (что само по себе приводит к замедлению роста опухоли), так и за счет действия цитокинов (итерлейкина 6 и интерлейкина 10, фактора некроза опухоли), ответственных за противоопухолевый эффект ФДТ [22, 25, 27].
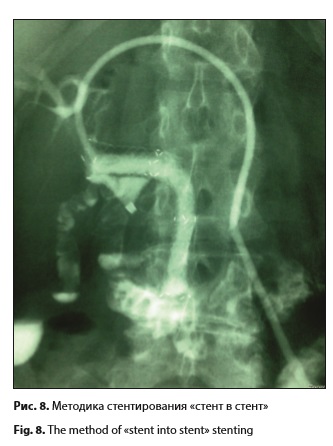
Все эти препараты можно использовать не только для однократной, но и для многокурсовой ФДТ [22]. Преимущество препаратов хлоринового ряда (радахлорин и фотолон) обусловлено более быстрым периодом выведения их из организма – до 48 ч, и небольшим сроком соблюдения светового режима пациентами. Однако для повторного проведения ФДТ необходимо дополнительное введение препарата. Что касается препарата фотосенс, то он имеет особенность длительно удерживаться в тканях (до 30% от максимальных значений определяется в течение недели после внутривенного введения), что дает возможность проведения до 5-7 сеансов облучения в эти сроки с коррекцией дозы лазерного облучения [22]. В дальнейшем концентрация препарата медленно снижается. В следовых количествах (0,1 мкг/мл и менее) он обнаруживается до 14 нед после введения. Длительный период выведения препарата обуславливает его фототоксичность и требует длительного соблюдения светового режима. Методика диагностики опухоли желчных протоков, выполняемая с использованием видеофлуоресцентного модуля для эндоскопии и минимальноинвазивной хирургии, основана на преимущественном накоплении фотосенсибилизаторов в злокачественных новообразованиях по сравнению со здоровыми тканями. При этом представляется возможность визуально за счет флуоресценции определить границы опухолевого поражения [23–27]. Идентичные исследования были проведены в различных учреждениях, о чем свидетельствуют публикации в периодической печати [19, 23, 26, 28]. У всех 14 пациентов было получено видеофлуоресцентное изображение опухоли желчных протоков. При этом показано, что одновременно возможно произвести измерение уровня накопления фотосенсибилизатора в интересующих участках по уровню его флуоресценции. В нашем исследовании была использована новая диагностическая установка, которая позволяет одновременно получать визуальное изображение флуоресценции и диагностический параметр, характеризующий уровень накопления фотосенсибилизатора в тканях. Уровень накопления фотосенсибилизатора в опухоли превышал в два раза и более уровень его накопления в нормальной ткани. Следует отметить, что для удобства диагностики эндоскоп следует проводить через двухканальный интрадьюсер, позволяющий одновременно с исследованием промывать желчные протоки от поступающей в поле зрения желчи и крови, которые могут давать ложную флуоресценцию или, наоборот, экранировать лазерное излучение. У 1 из 14 пациентов был установлен непокрытый нитиноловый стент в область стриктуры общего желчного протока и проведена ФДТ. Через 9 мес после операции у пациента были отмечены признаки желчной гипертензии, которые были связаны с распространением опухолевой инфильтрации выше стента с образованием стриктуры общего печеночного протока. После того как было выполнено желчеотведение, при фистулографии было установлено, что просвет стента проходим для контрастного препарата. Пациенту был выполнен повторный курс ФДТ с последующим рестентированием по типу стент в стент (рис. 8). После лечения пациент прожил еще 12 мес, сохраняя трудовую и социальную активность. Что касается основной причины повторной желтухи после ранее выполненного стентирования, то мы считаем, что это обусловлено обструкцией стента за счет врастания опухоли в непокрытый стент и распространением опухолевой инфильтрации за его границы. Такого же мнения придерживаются другие авторы [12, 13, 29, 30]. Поэтому крайне важно наладить как можно более длительную проходимость протоков для улучшения качества жизни пациентов [11]. Для предотвращения прогрессирования заболевания могут применяться различные методики локорегионарного воздействия, в частности внутрипротоковая лучевая, химиотерапия и фотодинамическая терапия [11, 19, 28, 29]. При этом в случае лучевой терапии необходимость подведения больших доз излучения несет в себе потенциальные риски развития осложнений и повреждений окружающих тканей и органов, как во время лечения, так и в отдаленном периоде [2]. Что касается химиотерапии, то в качестве самостоятельного метода лечения ХЦР она малоэффективна, частичный эффект не превышает 20–30% [2, 24]. Кроме того, желтуха, печеночная недостаточность и сопутствующий холангит затрудняют ее применение у такой категории больных. Мы в своей работе основывались на локорегионарном фотодинамическом воздействии на опухолевую стриктуру желчных протоков [22, 25, 26]. При этом возникает фотохимическая реакция, вызывающая образование синглетного кислорода, который воздействует на опухолевые клетки, вызывая их гибель [9]. Кроме того, помимо прямого фототоксического воздействия на опухолевые клетки, важную роль в механизме деструкции имеет нарушение кровоснабжения опухоли за счет микротромбоза и повреждения эндотелия питающих опухоль сосудов [22]. На сосудистый механизм приходится до 60% противоопухолевого действия ФДТ. Наряду с этим, ФДТ стимулирует иммунные реакции организма против опухоли как за счет активации лимфоцитов, нейтрофилов и макрофагов в подвергнутой ФДТ ткани опухоли (что само по себе приводит к замедлению роста опухоли), так и за счет действия цитокинов (итерлейкина 6 и интерлейкина 10, фактора некроза опухоли), ответственных за противоопухолевый эффект ФДТ [22, 25, 27].

Заключение
Применение минимальноинвазивного метода лечения холангиокарциномы в сочетании с желчеотведением, эндовидеофлуоресцентной диагностикой, фотодинамической терапией и стентированием желчных протоков позволяет расширить возможности оказания паллиативной помощи при нерезектабельной опухоли и для функционально неоперабельных больных. Флуоресцентная диагностика позволила у всех 14 пациентов, участвующих в исследовании, получить эндовидеофлуоресцентное изображение опухоли и определить место прицельной биопсии. Показано, что ФДТ в сочетании со стентированием желчных протоков увеличивает продолжительность жизни пациентов, не снижая ее качество. Выполнение ФД и ФДТ возможно без анестезии и при сохраняющихся явлениях желтухи в отличие от лучевой терапии и химиотерапии. Можно сделать вывод, что первые результаты клинического применения разработанной методики являются обнадеживающими, но требуют дальнейшего накопления клинического опыта.
ЛИТЕРАТУРА 1. Ветшев П.С. Диагностический подход при обтурационной желтухе // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 1999. – № 6. – С. 18-24. 2. Чистяков С.С. Онкология для практикующих врачей. – Москва: Изд-во «Товарищество научных изданий КМК», 2009. – 634 с. 3. Майстренко Н.А., Шейко С.Б., Алентьев А.В., Азимов Ф.Х. Холангиоцеллюлярный рак (особенности диагностики и лечения) // Практическая онкология. – 2008. – Т. 9, № 4 – С. 229-236. 4. Isayama H., Tsujino T., Nakai Y., et al. Clinical benefit of radiation therapy and metallic stenting for unresectable hilar cholangiocarcinoma // World J Gastroenterol. – 2012. – Vol. 18. – P. 23642370. doi: 10.3748/wjg.v18.i19.2364. 5. Шевченко Ю.Л., Карпов О.Э., Ветшев П.С. и соавт. Применение саморасширяющихся нитиноловых стентов при механической желтухе опухолевого генеза // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. – 2014. – T. 9, № 2. – С. 30-34. 6. Hucl T. Malignant biliary obstruction // Cas. Lek. Cesk. – 2016. – Vol. 155(1). – P. 30-7. 7. Khan S.A., Thomas H.C., Davidson B.R., Taylor-Robinson S.D. Cholangiocarcinoma // Lancet. – 2005. – Vol. 366, No. 9493. – P. 1303-1305. 8. Вakhru M., Tekola B., Kahaleh M. Endoscopic palliation for pancreatic cancer // Cancers (Basel). – 2011. – Vol. 3, No. 2. – P. 1947-1956. 9. Lee T.Y., Cheon Y.K., Shim C.S. Current status of photodynamic therapy for bile duct cancer // Clin Endosc. – 2013. – Vol. 46(1). – P. 38-44. doi: 10.5946/ce.2013.46.1.38. 10. Quyn A.J., Ziyaie D., Polignano F.M., Tait I.S. Photodynamic therapy is associated with an improvement in survival in patients with irresectable hilar cholangiocarcinoma // HPB (Oxford). – 2009. – Vol. 11. – P. 570-577. 11. Tan Y., Zhu J.Y., Qiu B.A. et al. Percutaneous biliary stenting combined with radiotherapy as a treatment for unresectable hilar cholangiocarcinoma // Oncol Lett. – 2015. – 10(4). – P. 2537-2542. 12. Kose F., Oguzkurt L., Besen A. et al. Effectiveness of percutaneous metal stent placement in cholangiocarcinoma patients with midterm follow-up: Single center experience // Eur J Radiol. – 2012. – Vol. 81. – P. 1724-1727. doi:10.1016/j. ejrad.2011.04.056. 13. Kipp B.R., Stadheim L.M., Halling S.A., Pochron N.L., Harmsen S., Nagorney D.M., et al. A comparison of routine cytology and fluorescence in situ hybridization for the detection of malignant bile duct strictures // Am J Gastroenterol. – 2004. – Vol. 99. – P. 1675-1681. 14. Кулезнева Ю.В., Бруслик С.В., Мусаев Г.Х. и соавт. Антеградные методы декомпрессии желчных протоков: эволюция и спорные вопросы // Анналы хирургической гепатологии. – 2011. – Т. 16, № 3. – С. 35-43. 15. Вишневский В.А., Тарасюк Т.И. Диагностика и хирургическое лечение рака проксимальных печеночных протоков (опухолей Клатскина) // Практическая онкология. – 2004. – Т. 5, № 2. – С. 126-134. 16. Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. – Москва: Видар, 2009. – 568 с. 17. Охотников О.И., Григорьев С.Н., Яковлева М.В. Антеградные эндобилиарные вмешательства при синдроме механической желтухи // Анналы хирургической гепатологии. – 2011. – Т. 16, № 3. – С. 44-49. 18. Jaganmohan S., Lee J.H. Self-expandable Metal Stents in Malignant Biliary Obstruction Surgical versus Endoscopic Biliary Drainage // Expert Rev Gastroenterol Hepatol. – 2012. – Vol. 6, No. 1. – P. 105-114.
19. Лобаков А.И., Странадко Е.Ф., Мокин М.В. и соавт. Возможности фотодинамической терапии в лечении рака большого дуоденального сосочка // Анналы хирургической гепатологии. – 2005. – Т. 10, № 1. – С. 86-89. 20. Rerknimitr R., Angsuwatcharakon P., Ratanachu-ek T., et al. Asia-pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma // J Gastroenterol Hepatol. – 2013. – Vol. 28. – P. 593-607. 21. Höblinger A., Gerhardt T., Gonzalez-Carmona M.A., et al. Feasibility and safety of long-term photodynamic therapy (PDT) in the palliative treatment of patients with hilar cholangiocarcinoma // Eur J Med Res. – 2011. – Vol. 16. – P. 391-395. doi: 10.1186/2047-783X-16-9-391. 22. Чиссов В.И., Филоненко Е.В. Флуоресцентная диагностика и фотодинамическая терапия в клинической онкологии. – Москва: Изд-во Триумф, 2012. – 272 с. 23. Kniebühler G.1., Pongratz T., Betz C.S., et al. Photodynamic therapy for cholangiocarcinoma using low dose mTHPC (Foscan(®)) // Photodiagnosis Photodyn Ther. – 2013. – Vol. 10(3). – P. 220-8. doi: 10.1016/j.pdpdt.2012.12.005. 24. Wentrup R, Winkelmann N, Mitroshkin A, et al. Photodynamic Therapy Plus Chemotherapy Compared with Photodynamic Therapy Alone in Hilar Nonresectable Cholangiocarcinoma // Gut Liver. – 2016. – Vol. 10(3). – P. 470-5. doi: 10.5009/gnl15175. 25. Levkin V., Gagarina N., Kharnas S., Musaev G., et al. Modern Technologies for Timely Detection and Differential Diagnosis of Gastric Cancer / New Aspects in Molecular and Cellular Mechanisms of Human Carcinogenesis, Dmitry Bulgin (Ed.). – InTech, 2016. doi: 10.5772/59826. 26. Chen Y.J., Jiang H.T., Cao J.Y. Influence of Photodynamic Therapy on Apoptosis and Invasion of Human Cholangiocarcinoma QBC939 Cell Line // Chin. Med. Sci. J. – 2015. – Vol. 30(4). – P. 252-9. 27. Цыб А.Ф., Каплан М.А., Романенко Ю.С., Попучиев В.В. Клинические аспекты фотодинамической терапии. – Калуга: Изд-во науч. литер-ры. Н.Ф. Бочкаревой, 2009. – 204 с. 28. Ortner M.E., Caca K., Berr F., et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study // Gastroenterology. – 2003. – Vol. 125(5). – P. 1355-63. 29. Макаров Е.С., Нечушкин М.И., Долгушин Б.И., Файнштейн И.А. Внутрипросветная лучевая терапия местнораспространенного рака внепеченочных желчных протоков // Анналы хирургической гепатологии. – 2006. – Т. 11, № 1. – С. 45-53. 30. Tapping C.R., Byass O.R., Cast J.E. Percutaneous transhepatic biliary drainage (PTBD) with or without stenting-complications, re-stent rate and a new risk stratification score // Eur Radiol. – 2011. – Vol. 21. – P. 1948-1955. doi: 10.1007/s00330011-2121-7.
19. Лобаков А.И., Странадко Е.Ф., Мокин М.В. и соавт. Возможности фотодинамической терапии в лечении рака большого дуоденального сосочка // Анналы хирургической гепатологии. – 2005. – Т. 10, № 1. – С. 86-89. 20. Rerknimitr R., Angsuwatcharakon P., Ratanachu-ek T., et al. Asia-pacific consensus recommendations for endoscopic and interventional management of hilar cholangiocarcinoma // J Gastroenterol Hepatol. – 2013. – Vol. 28. – P. 593-607. 21. Höblinger A., Gerhardt T., Gonzalez-Carmona M.A., et al. Feasibility and safety of long-term photodynamic therapy (PDT) in the palliative treatment of patients with hilar cholangiocarcinoma // Eur J Med Res. – 2011. – Vol. 16. – P. 391-395. doi: 10.1186/2047-783X-16-9-391. 22. Чиссов В.И., Филоненко Е.В. Флуоресцентная диагностика и фотодинамическая терапия в клинической онкологии. – Москва: Изд-во Триумф, 2012. – 272 с. 23. Kniebühler G.1., Pongratz T., Betz C.S., et al. Photodynamic therapy for cholangiocarcinoma using low dose mTHPC (Foscan(®)) // Photodiagnosis Photodyn Ther. – 2013. – Vol. 10(3). – P. 220-8. doi: 10.1016/j.pdpdt.2012.12.005. 24. Wentrup R, Winkelmann N, Mitroshkin A, et al. Photodynamic Therapy Plus Chemotherapy Compared with Photodynamic Therapy Alone in Hilar Nonresectable Cholangiocarcinoma // Gut Liver. – 2016. – Vol. 10(3). – P. 470-5. doi: 10.5009/gnl15175. 25. Levkin V., Gagarina N., Kharnas S., Musaev G., et al. Modern Technologies for Timely Detection and Differential Diagnosis of Gastric Cancer / New Aspects in Molecular and Cellular Mechanisms of Human Carcinogenesis, Dmitry Bulgin (Ed.). – InTech, 2016. doi: 10.5772/59826. 26. Chen Y.J., Jiang H.T., Cao J.Y. Influence of Photodynamic Therapy on Apoptosis and Invasion of Human Cholangiocarcinoma QBC939 Cell Line // Chin. Med. Sci. J. – 2015. – Vol. 30(4). – P. 252-9. 27. Цыб А.Ф., Каплан М.А., Романенко Ю.С., Попучиев В.В. Клинические аспекты фотодинамической терапии. – Калуга: Изд-во науч. литер-ры. Н.Ф. Бочкаревой, 2009. – 204 с. 28. Ortner M.E., Caca K., Berr F., et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study // Gastroenterology. – 2003. – Vol. 125(5). – P. 1355-63. 29. Макаров Е.С., Нечушкин М.И., Долгушин Б.И., Файнштейн И.А. Внутрипросветная лучевая терапия местнораспространенного рака внепеченочных желчных протоков // Анналы хирургической гепатологии. – 2006. – Т. 11, № 1. – С. 45-53. 30. Tapping C.R., Byass O.R., Cast J.E. Percutaneous transhepatic biliary drainage (PTBD) with or without stenting-complications, re-stent rate and a new risk stratification score // Eur Radiol. – 2011. – Vol. 21. – P. 1948-1955. doi: 10.1007/s00330011-2121-7.
Наши больницы
Наши больницы на карте
Университетская клиническая больница №1
Университетская клиническая больница №2
Университетская клиническая больница №3
Университетская клиническая больница №4
Университетская клиническая больница №5
Сеченовский центр материнства и детства
Центр Кардиоангиологии (НПЦИК)
Институт Стоматологии им. Е.В. Боровского
Институт медицинской паразитологии, тропических и трансмиссивных заболеваний им. Е.И. Марциновского
Клиника акушерства и гинекологии им. В.Ф. Снегирева


