Лазерная видеофлюоресцентная диагностика заболеваний желудка
М.В. Лощенов, к.ф.-м.н., научный сотрудник лаборатории лазерной биоспектроскопии Центра естественно-научных исследований1;
В.В. Левкин, д.м.н., профессор кафедры факультетской хирургии №12;
А.Ф. Черноусов, д.м.н., профессор, академик РАН, зав. кафедрой факультетской хирургии №12;
Н.А. Калягина, к.ф.-м.н., научный сотрудник лаборатории лазерной биоспектроскопии Центра естественно-научных исследований1; научный сотрудник3;
С.С. Харнас, д.м.н., профессор кафедры факультетской хирургии №12;
В.Я. Заводнов, к.м.н., зав. межклиническим эндоскопическим отделением2;
К.Г. Линьков, к.т.н., старший научный сотрудник лаборатории лазерной биоспектроскопии Центра естественно-научных исследований1;
Г.Х. Мусаев, д.м.н., профессор кафедры факультетской хирургии №12;
А.В. Егоров, д.м.н., профессор кафедры факультетской хирургии №12; Р.В. Карпова, д.м.н., профессор кафедры факультетской хирургии №12;
В.К. Рыбин, к.м.н., доцент кафедры факультетской хирургии №12;
Т.В. Хоробрых, д.м.н., профессор кафедры факультетской хирургии №12
1Институт общей физики им. А.М. Прохорова Российской академии наук, ул. Вавилова, 38, Москва, 119991; 2Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский университет), ул. Трубецкая, 8, стр. 2, Москва, 119991; 3Национальный исследовательский ядерный университет «МИФИ», Каширское шоссе, 31, Москва, 115409
Цель исследования — оценить эффективность метода регистрации видеофлюоресценции 5-АЛК-индуцированного протопорфирина IX при заболеваниях желудка и пищевода и адаптировать его для клинических условий — проведения дифференциальной диагностики и выявления предраковых состояний, а также сформулировать рекомендации по дозировкам и времени применения фотосенсибилизатора при диагностике данных заболеваний. Материалы и методы. Регистрацию флюоресценции в диагностических целях проводили 57 пациентам с заболеваниями желудка и пищевода (преимущественно с раком желудка) с помощью одноканальной (n=50) и двухканальной (n=7) лазерной видеофлюоресцентной системы регистрации. Исследование осуществляли с использованием 5-аминолевулиновой кислоты (препарат Аласенс). Выполнено 39 эндоскопических, 18 интраоперационных/лапароскопических исследований и 7 исследований на макропрепарате. Результаты. Флюоресценция при использовании обеих установок не регистрировалась при язвенной болезни и хроническом гастрите, в случаях массивных некрозов опухоли и примеси крови в желудке, а также у больного с субкомпенсированным стенозом и стентированием выходного отдела желудка при отсутствии прорастания серозной оболочки желудка и низкой концентрации 5-АЛК. Во всех остальных случаях зарегистрирована отчетливая флюоресценция, данные которой могут быть использованы для постановки точного диагноза и принятия решения о дальнейшей тактике лечения. Заключение. Лазерная видеофлюоресцентная диагностика является перспективным методом дифференциальной диагностики и установления распространенности опухолевого процесса в желудке и пищеводе и может быть использована в качестве экспресс-метода в диагностически сложных случаях. Ключевые слова: рак желудка; 5-аминолевулиновая кислота; Аласенс; лазерная диагностика; видеофлюоресценция; лазерная видеофлюоресцентная диагностика. Как цитировать: М.В. Лощенов, В.В. Левкин, А.Ф. Черноусов, Н.А. Калягина, С.С. Харнас, В.Я. Заводнов, К.Г. Линьков, Г.Х. Мусаев, А.В. Егоров, Р.В. Карпова, В.К. Рыбин, Т.В. Хоробрых Лазерная видеофлюоресцентная диагностика заболеваний желудка Sovremennye tehnologii v medicine 2018; 10(3): ??–??, https://doi.org/10.17691/stm2018.10.3.0
Введение
Рак желудка является третьей ведущей причиной смерти от рака во всем мире, при этом только у 28,3% больных достигается пятилетняя выживаемость [1]. Хорошо известно, какую роль в результатах лечения этой патологии играет своевременная диагностика. Основным методом диагностики рака желудка, позволяющим получить морфологическое подтверждение, служит эндоскопическое исследование [2]. В последнее время для повышения эффективности стандартной гастроскопии разрабатываются различные уточняющие технологии. Примером такой техно
логии является метод, основанный на регистрации флюоресценции с возможностью исследования воздействия возбуждающего света на опухолевую ткань. Суть метода заключается в регистрации фотонов, испускаемых веществом при поглощении им квантов лазерного излучения при переходе из возбужденного состояния в основное. Этот процесс получил название флюоресценции и может быть зарегистрирован с помощью специальной аппаратуры или визуально. Такие методы уже применяются для диагностики и лечения опухолей различных локализаций [3–7]. Их использование в гастроэнтерологии потенциально позволит повысить эффективность стандартного эндоскопического исследования при раке.
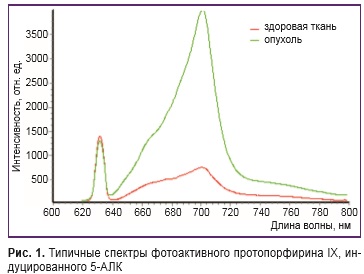
Новые возможности метод лазерной флюоресцентной диагностики получил с синтезом 5-аминолевулиновой кислоты (5-АЛК) [8]. Это соединение не является фотосенсибилизатором, но индуцирует в клетках опухоли синтез и накопление фотоактивного протопорфирина IХ (ПП IX) — предшественника гема. Ежедневно в организме человека синтезируется около 350 мг 5-АЛК, что обеспечивает нормальное кроветворение. Известно, что опухолевые клетки способны к повышенному накоплению ПП IX в присутствии экзогенной 5-АЛК [9–12]. Это связывают с большей активностью в опухолевых клетках ферментов начального этапа синтеза гема, а также с дефицитом в них феррохелатазы (фермента, превращающего ПП IX в гем [13, 14]. Таким образом, интенсивность флюоресценции злокачественной опухоли относительно окружающих тканей оказывается существенно выше и это обеспечивает более высокую по сравнению с аутофлюоресценцией диагностическую результативность метода. Быстрый метаболизм 5-АЛК практически полностью исключает фототоксичность. Препарат Аласенс удобен для перорального приема, не имеет специфических противопоказаний. Оптимальный интервал времени для диагностики (вне зависимости от характера исследования — эндоскопическое, лапароскопическое или интраоперационное) — 2–4 ч после его приема. Оптимальная доза препарата составляет 20 мг/кг массы тела. Интенсивность индуцированной 5-АЛК флюоресценции (рис. 1) столь значительна, что ее можно регистрировать не только с помощью спектроанализаторов, но и специальными высокочувствительными камерами, что открывает большие перспективы. Однако задача проведения диагностических исследований верхних отделов желудочного тракта с помощью гастроскопических систем видеорегистрации до сих пор не решена. Цель исследования — оценить эффективность метода регистрации видеофлюоресценции 5-АЛК индуцированного протопорфирина IX при заболеваниях желудка и пищевода и адаптировать его для клинических условий — проведения дифференциальной диагностики и выявления предраковых состояний, а также сформулировать рекомендации по дозировкам и времени применения фотосенсибилизатора при диагностике данных заболеваний.
Материалы и методы
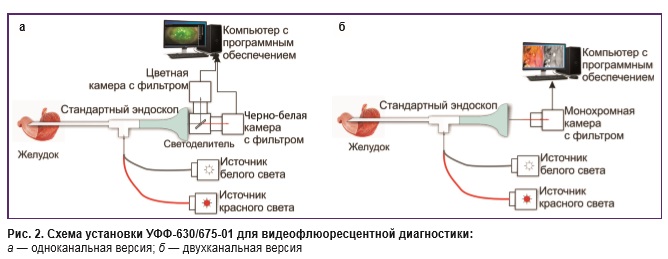
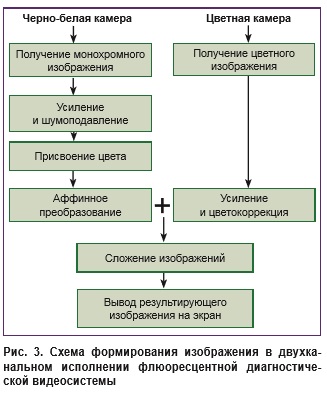
Авторами созданы два макета анализатора флюоресцентных изображений (одноканального и двухканального), совместимых со стандартным гастроэндоскопом и не имеющих аналогов в мире. Указанные макеты совместимы и с лапароскопическим оборудованием, что позволяет осуществлять интраоперационную/лапароскопическую оценку распространенности опухолевого процесса и даже выявлять очаги микроканцероматоза [8]. Одноканальное устройство состоит из высокочувствительной черно-белой камеры (0,0003 лк) и системы светофильтров, позволяющей не только выполнять исследование в видимом световом диапазоне, но и регистрировать возбужденную лазером (630 нм, 1,5 Вт) флюоресценцию — система УФФ-630/675-01, одноканальная версия («Биоспек», Россия) (рис. 2). Через специальный переходник волновод гастроскопа подсоединяется к волноводу от светодиодного лазера. Двухканальная установка позволяет осуществлять осмотр слизистой оболочки желудка в обычном белом свете и одновременно производить облучение лазерным излучением с последующей фиксацией флюоресценции в заданном цвете (например, в зеленом). Кроме того, одновременно происходит измерение коэффициента диагностической контрастности, что позволяет не прибегать к спектроскопии (рис. 2, 3). Исследования проводили в Клинике факультетской хирургии им. Н.Н. Бурденко совместно с межклиническим эндондоскопическим отделением Первого Московского государственного медицинского университета им. И.М. Сеченова в период с 2003 по 2017 гг. Работа соответствует принципам Хельсинкской декларации (2013) и одобрена Этическим комитетом Первого Московского государственного медицинского университета им. И.М. Сеченова. От каждого пациента получено информированное согласие. За 2–4 ч до предполагаемого исследования (эндоскопического, лапароскопического или интраоперационного) пациент перорально однократно принимал раствор Аласенса в дозе 10–25 мг/кг массы тела. Фотодерматоза и токсическо-аллергических реакций на введение препарата не отмечено. Если пациент применял антацидные препараты, Н2-гистаминовые блокаторы или блокаторы протоновой помпы, их отменяли не менее чем за двое суток до проведения флюо ресцентной диагностики.
Регистрацию эндоскопической видеофлюоресценции у 50 пациентов осуществляли с помощью одноканального устройства — насадки для стандартного эндоскопа. Всего на этой установке выполнено 35 эндоскопических видеофлюоресцентных исследований слизистой оболочки желудка, 15 интраоперационных и 7 видеофлюоресцентных исследований макропрепарата. У 7 пациентов была использована модернизированная двухканальная установка, которая, как уже описывалось выше, позволяет производить осмотр в обычном белом свете с одновременным облучением лазерным излучением и фиксацией флюоресценции в заданном цвете (например, в зеленом). Всего на этой установке было выполнено 4 видеофлюоресцентных эзогастродуоденоскопии, 1 лапароскопическое и 2 интраоперационных исследования. При интраоперационном/лапароскопическом исследовании распространенности опухолевого процесса (n=18) — прежде всего для обнаружения и верификации участков канцероматоза — применяли аналогичную методику. Для этого использовали стандартный лапароскоп и описанные устройства. Лапароскоп располагали на расстоянии от 1 до 3 см от изучаемой поверхности. Последовательно исследовали стенки желудка со стороны серозной оболочки (при необходимости вскрывали сальниковую сумку), печень, латеральные каналы, брюшину передней брюшной стенки, петли тонкой кишки, малый таз. Если с момента введения Аласенса до выполнения субтотальной резекции желудка или гастрэктомии проходило не более 4–5 ч, проводили исследования макропрепарата как со стороны слизистой, так и со стороны серозной оболочки.
Результаты
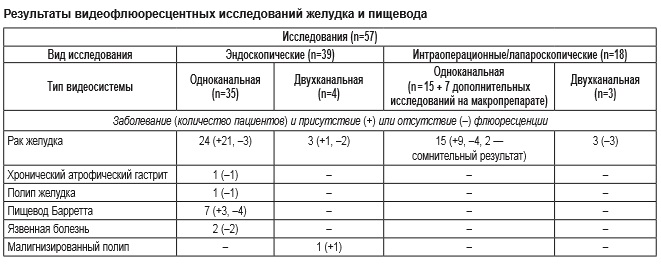
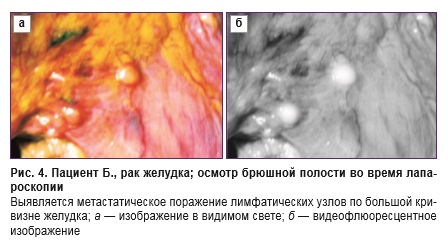
Флюоресцентные изображения желудка при эндоскопическом исследовании на одноканальной системе показали отчетливую флюоресценцию опухоли у 21 из 24 пациентов (87,5%) (см. таблицу). У 3 больных флюоресценция отсутствовала из-за субтотального поражения желудка, что привело к недостаточной степени всасывания препарата Аласенс. Соответственно и коэффициент диагностической контрастности при проведении спектроскопии у них был низким. У 4 больных (у 2 — язвенная болезнь, у 1 — хронический атрофический гастрит и у 1 — полип желудка) флюоресценция отсутствовала и диагноз рака желудка был исключен (ложноположительных результатов не зарегистрировано). Из 7 видеофлюоресцентных исследований при пищеводе Барретта флюоресценция отмечена у трех пациентов. В ходе гистологического исследования у них обнаружена тяжелая степень дисплазии, опухолевого роста не выявлено. При использовании двухканальной установки получены следующие результаты: отчетливое свечение отмечено у 1 больного раком желудка и у 1 — с малигнизированным полипом, у 2 больных раком желудка отчетливо зафиксировать флюоресценцию не удалось из-за массивных поверхностных некрозов опухоли и наличия примеси крови в желудке. При интраоперационном/лапароскопическом исследовании на одноканальной установке отчетливую флюоресценцию наблюдали в случае, если опухоль прорастала серозный покров желудка или инфильтрировала близлежащие органы и ткани (при наличии канцероматоза). Указанные изменения отмечены в 8 наблюдениях. Если опухоль не прорастала сквозь все слои стенки желудка, зарегистрировать флюоресценцию не удавалось (4 наблюдения), в 2 случаях результаты исследования расценены как сомнительные: флюоресценция была видна неотчетливо (при гистологическом исследовании опухоль прорастала субсерозную оболочку, но инвазии серозного покрова не отмечено). У одного пациента опухоль не прорастала серозную оболочку, но при этом обнаружены метастазы в регионарные лимфатические узлы, флюоресценция которых была отчетливо зафиксирована (рис. 4). При исследовании 7 макропрепаратов отчетливая флюоресценция отмечена в 1 наблюдении, в остальных случаях она либо отсутствовала, либо была признана сомнительной. В случае использования модернизированной двухканальной установки при лапароскопии у больного с прорастанием серозной оболочки и массивным канцероматозом брюшины флюоресценция отсутствовала. Причиной этому послужило наличие у больного стента, установленного по поводу субкомпенсированного стеноза, что привело к быстрой эвакуации 5-АЛК из желудка и к отсутствию ее всасывания. В 2 интраоперационых исследованиях флюоресценция не зарегистрирована из-за отсутствия прорастания серозной оболочки. Видеофлюоресцентных исследований на макропрепаратах не проводили.
Обсуждение
В последние десятилетия отмечается бурное развитие эндоскопических технологий. Тем не менее в ряде случаев провести дифференциальную диагностику между доброкачественными и злокачественными изменениями в желудке бывает не просто, как и оценить истинную распространенность процесса при лапароскопии или интраоперационно. Такая ситуация обусловливает разработку новых и совершенствование имеющихся технологий. Одним из наиболее перспективных методов для решения данной задачи является лазерная спектро- и видеофлюоресцентная диагностика. Процедура флюоресцентной диагностики лишь незначительно удлиняет время эзогастродуоденоскопии (в отличие от хромоэндоскопии), лапароскопии или операции, а заключение о характере патологического процесса может быть получено сразу, в процессе проведения исследования. Комплекс аппаратуры, применяемой для проведения флюоресцентной диагностики, достаточно компактный и мобильный (вне зависимости от модификации установки. Метод спектральной видеофлюоресцентной диагностики показан в сложных диагностических ситуациях при подозрении на рак желудка и в силу своей относительной простоты и безопасности в перспективе может стать стандартным этапом эндоскопического исследования. Нецелесообразно использовать флюоресцентные методы исследования больным с заведомо установленным диагнозом рака желудка, а также при подозрении на тотально-субтотальное поражение органа из-за возможного нарушения всасывания препарата. Кроме того, массивные некротические изменения на поверхности опухоли при запущенных стадиях рака не позволяют осуществить полноценную спектральную и видеофлюоресцентную диагностику. В то же время при преимущественно подслизистом характере роста опухоли, когда результаты стандартного эндоскопического исследования и данные биопсии обычно мало информативны, флюоресцентная диагностика может служить весьма эффективным методом исследования. Исследование видеофлюоресценции с применением 5-АЛК-индуцированного ПП IX можно рекомендовать для использования в клинике как экспрессметод диагностики, в том числе ранней диагностики злокачественных заболеваний желудка, а также для интраоперационной оценки распространенности опухоли и выявления очагов канцероматоза при лапароскопии.
Заключение
Регистрация видеофлюоресценции с применением разработанных анализаторов флюоресцентных изображений позволяет с высокой степенью точности проводить дифференциальную экспресс-диагностику заболеваний желудка, осуществлять раннюю диагностику рака и выявлять предраковые состояния. Первый опыт применения видеофлюоресцентной диагностики рака желудка с препаратом 5-АЛК Аласенс продемонстрировал ее достаточно высокую диагностическую значимость и перспективность. Повышение чувствительности методики и улучшение качества изображения позволят создать серийные образцы оборудования и способствовать внедрению метода в широкую клиническую практику.
Финансирование исследования. Исследование не финансировалось какими-либо источниками. Конфликт интересов. У авторов нет конфликта интересов.
Литература/References
1. Marqués-Lespier J.M., González-Pons M., CruzCorrea M. Current perspectives on gastric cancer. Gastroenterol Clin North Am 2016; 45(3): 413–428, https:// doi.org/10.1016/j.gtc.2016.04.002. 2. Waddingham W., Graham D., Banks M., Jansen M.F. The evolving role of endoscopy in the diagnosis of premalignant gastric lesions. F1000Res 2018; 7: 715, https:// doi.org/10.12688/f1000research.12087.1. 3. Соколов В.В., Чиссов В.И., Филоненко Е.В., Телегина Л.В., Трахтенберг А.Х., Франк Г.А., Булгакова Н.Н. Флюоресцентная диагностика раннего центрального рака легкого. Пульмонология 2005; 1: 107–116. Sokolov V.V., Chissov V.I., Filonenko E.V., Telegina L.V., Trakhtenberg A.Kh., Frank G.A., Bulgakova N.N. Fluorescence detection of early central lung cancer. Pul’monologia 2005; 1: 107–116. 4. Ягудаев Д.М., Сорокатый А.Е., Мартов А.Г., Гейниц А.В., Маркова М.В. Фотодинамическая терапия аденомы предстательной железы. Урология 2007; 4: 34– 37. Yagudaev D.M., Sorokaty A.E., Martov A.G., Heinits A.V., Markova M.V. Photodynamic therapy of prostatic adenoma. Urologia 2007; 4: 34–37. 5. Цыб А.Ф., Каплан М.А., Молочков В.А., Миронов А.Ф., Романко Ю.С., Капинус В.Н., Третьякова Е.И., Сухова Т.Е. О применении фотодинамической терапии в лечении солитарных и множественных базалиом. Российский журнал кожных и венерических болезней 2000; 4(10): 4–12. Tsyb A.F., Kaplan M.A., Molochkov V.A., Mironov A.F., Romanko Yu.S., Kapinus V.N., Tretyakova Ye.I., Sukhova T.Ye. Use of photodynamic therapy in the treatment of solitary and multiple basal-cell carcinomas. Rossijskij zurnal koznyh i venericeskih boleznej 2000; 4(10): 4–12. 6. Новикова Е.Г., Трушина О.И., Соколов В.В., Фило ненко Е.В. Флюоресцентная диагностика и фотодинамическая терапия предопухолевой патологиии начальной формы рака шейки матки. Российский онкологический журнал 2005; 6: 28–33. Novikova E.G., Trushina O.I., Sokolov V.V., Filonenko E.V. Fluorescent diagnosis and photodynamic therapy of pretumor pathology and an initial form of uterine cervix cancer. Rossijskij onkologiceskij zurnal 2005; 6: 28–33. 7. Ягудаев Д.М., Гейниц А.В., Мартов А.Г., Сорокатый А.Е. Первые результаты применения фото динамической терапии при раке мочевого пузыря. Лазерная медицина 2004; 8(3): 242. Yagudajev D.M., Geinitz A.V., Martov A.G., Sorokatiy A.E. The first results of PDT used for urinary bladder cancer. Lazernaja medicina 2004; 8(3): 242. 8. Лощенов В.Б., Линьков К.Г., Савельева Т.А., Лощенов М.В., Модель С.С., Бородкин А.В. Аппаратурное и инструментальное обеспечение флюоресцентной диагностики и фотодинамической терапии. Фотодинамическая терапия и фотодиагностика 2013; 3: 17–25. Loschenov V.B., Linkov K.G., Savelieva T.A., Loschenov M.V., Model S.S., Borodkin A.V. Hardware and tool equipment for fluorescence diagnostics and photodynamic therapy. Fotodinamicheskaya terapiya i fotodiagnostika 2013; 3: 17–25. 9. Chen W.R., Jassemnejad B., Crull J., Knobbe E.T., Nordquist R.E. Detection and characterization of chemicalinduced abnormal tissue and rat tumors at different stages using fluorescence spectroscopy. Proc. SPIE 2679, Advances in Laser and Light Spectroscopy to Diagnose Cancer and Other Diseases III: Optical Biops 1996, https://doi. org/10.1117/12.237570. 10. Cheng C.W., Lau W.K., Tan P.H., Olivo M. Cystoscopic diagnosis of bladder cancer by intravesical instillation of 5-aminolevulinic acid induced porphyrin fluorescence — the Singapore experience. Ann Acad Med Singapore 2000; 29(2): 153–158. 11. Curnow A., McIlroy B.W., Postle-Hacon M.J., Porter J.B., MacRobert A.J., Bown S.G. Enhancement of 5-aminolevulinic acid-induced photodynamic therapy in normal rat colon using hydroxypyridinone iron-chelating agents. Br J Cancer 1998; 78(10): 1278–1282, https://doi.org/10.1038/bjc.1998.671. 12. Campbell D.L., Gudgin-Dickson E.F., Forkert P.G., Pottier R.H., Kennedy J.C. Detection of early stages of carcinogenesis in adenomas of murine lung by 5-aminolevulinic acid-induced protoporphyrin IX fluorescence. Photochem Photobiol 1996; 64(4): 676–682, https://doi. org/10.1111/j.1751-1097.1996.tb03123.x. 13. Battersby A.R., Fookes C.J., Matcham G.W., McDonald E. Biosynthesis of the pigments of life: formation of the macrocycle. Nature 1980; 285(5759): 17–21, https://doi. org/10.1038/285017a0. 14. Shemin D., Russell C.S. δ-aminolevulinic acid, its role in the biosynthesis of porphyrins and purines. J Am Chem Soc 1953; 75(19): 4873–4874, https://doi.org/10.1021/ ja01115a546.






